
医疗器械备案申请指南:流程、要点与注意事项详解
医疗器械申请备案说明
一、背景介绍
随着医疗技术的不断进步,医疗器械在医疗领域的应用越来越广泛。为了确保医疗器械的安全性和有效性,各国政府都对其进行了严格的监管。在中国,医疗器械的备案申请是一项重要的法规要求,涉及到医疗器械的生产、销售和使用等各个环节。本文将详细介绍医疗器械申请备案的相关流程和注意事项。

二、备案流程
前期准备
在申请备案之前,需要对所申请的医疗器械进行技术评估,确保符合国家和行业的相关规定。此外,还需要准备相关的申请材料,包括但不限于产品说明书、技术报告、质量检测报告等。

提交申请
将准备好的申请材料提交至所在地的食品药品监督管理部门。可以通过线上或线下的方式进行提交。
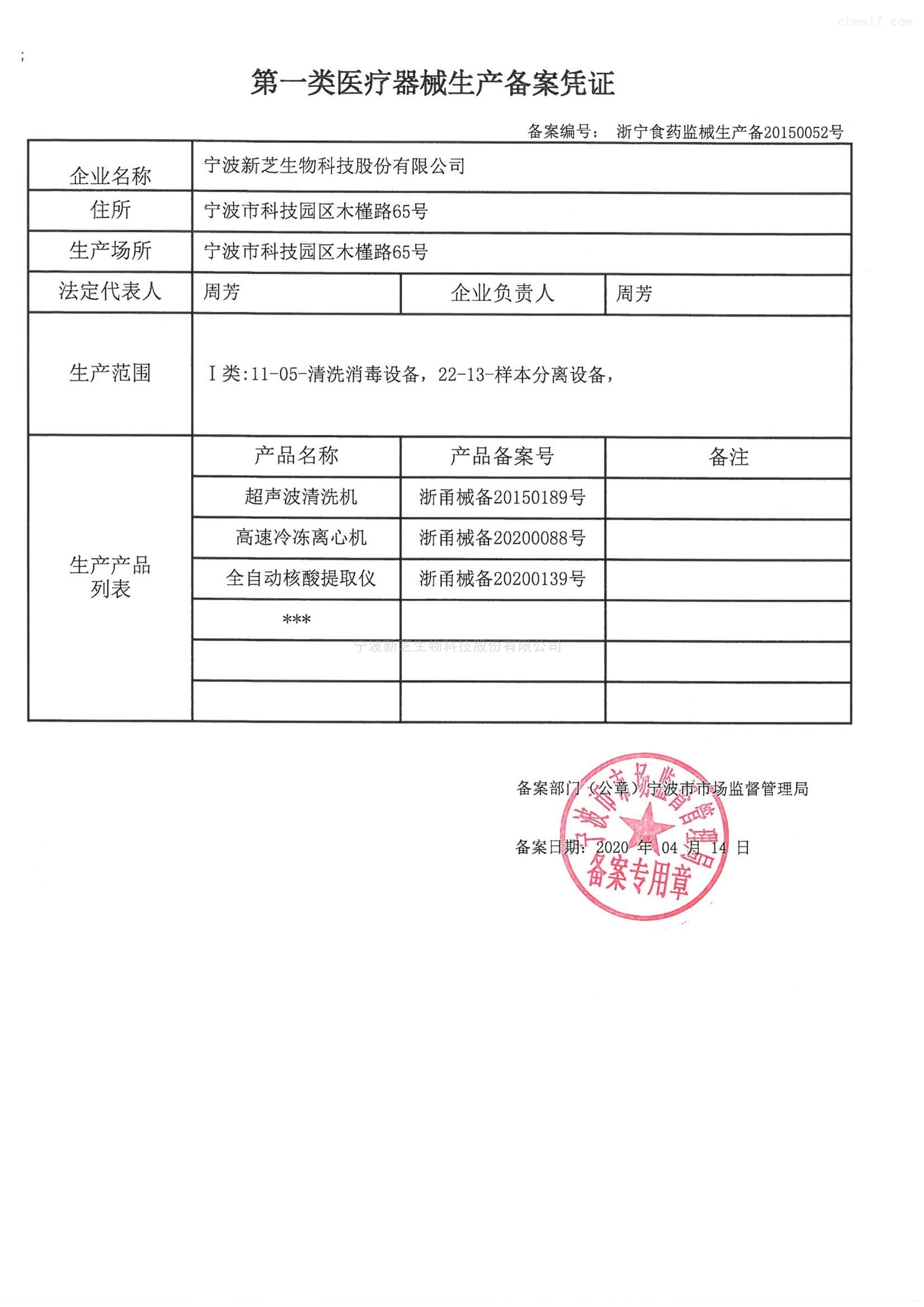
审核过程
提交申请后,食品药品监督管理部门将对申请材料进行审核。审核内容包括产品的安全性、有效性以及生产过程的合规性等。
审批结果
审核通过后,将获得备案证书和备案号,正式允许生产和销售。如未通过审核,将根据反馈意见进行整改并重新提交申请。
三、注意事项
- 申请材料需真实、准确、完整,不得有虚假内容。
- 提交的医疗器械必须符合国家相关标准和行业规定。
- 在生产过程中,应严格遵守生产规范和操作流程。
- 备案后如有变更,应及时向相关部门报告并重新备案。
- 定期进行产品质量检测和评估,确保产品的安全性和有效性。
四、总结
医疗器械的备案申请是确保医疗器械安全、有效的关键环节。企业在申请备案时,应充分了解相关法规和流程,确保申请材料的真实性和完整性。同时,在生产和使用过程中,应严格遵守相关法规和标准,确保医疗器械的安全性和有效性。






































