
【全新解读】一类医疗器械产品备案流程详解与样稿参考
发布时间:3 天前
阅读量:3
一类医疗器械产品备案样稿
一、引言
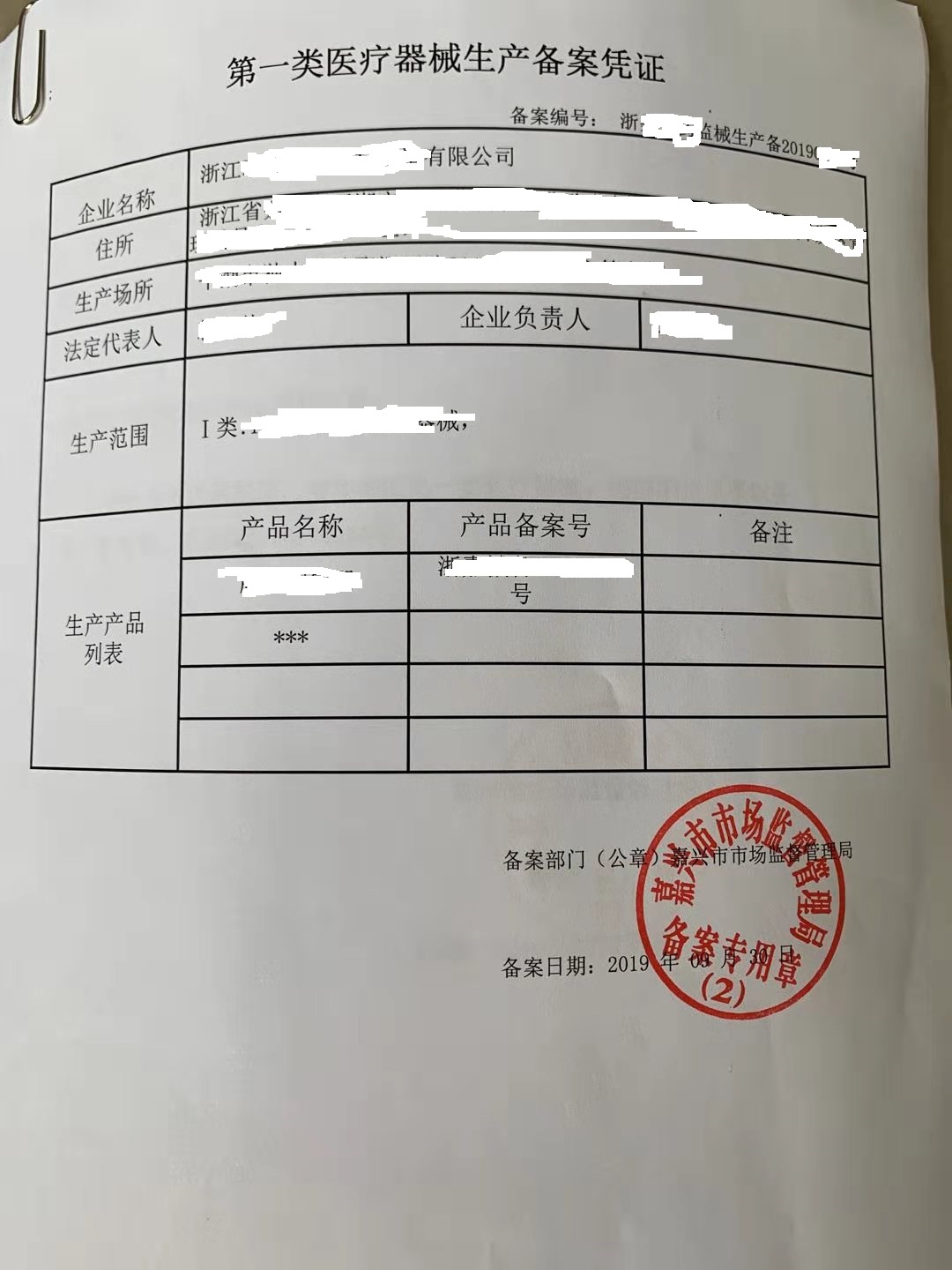
本文将详细介绍一类医疗器械产品的备案流程、相关注意事项以及所需的文件清单。为确保顺利备案,了解相关要求及准备材料是第一步。接下来我们一一解读相关细节。
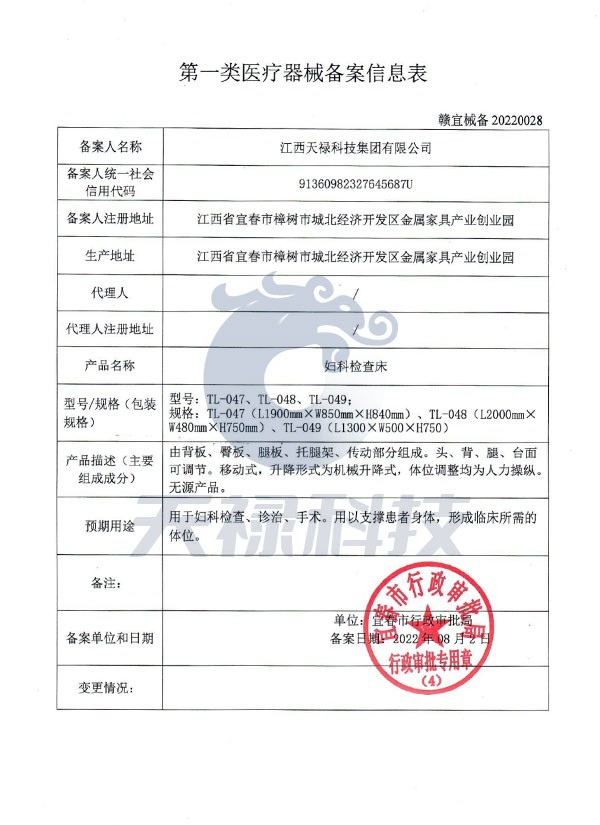
二、备案流程

备案一类医疗器械产品需要遵循以下流程:
- 准备阶段:包括明确产品类别、查阅相关法律法规和标准要求,并收集所需材料。
- 填写申请表格:确保表格填写完整无误,如产品名称、型号规格等关键信息准确无误。
- 提交资料:提交包括产品说明书、工艺流程图等必要的文档。
- 审核阶段:备案机构将对提交的资料进行审核,确认产品是否符合相关法规要求。
- 获得备案号:审核通过后,备案机构将发放备案号,标志着产品备案成功。
三、注意事项
在备案过程中需要注意以下几点:
- 确保产品的安全性和有效性,符合国家和行业标准要求。
- 提交的文档应真实、准确、完整,不得有虚假内容。
- 注意关注法规动态,确保备案材料符合最新的法规要求。
- 在规定时间内完成备案流程,避免过期或延误。
四、文件清单
备案所需文件包括但不限于以下内容:
- 产品说明书:包括产品名称、用途、性能参数等信息。
- 工艺流程图:展示产品的生产工艺流程。
- 质量管理体系文件:如质量控制计划等。
- 检测报告:包括原材料检测、产品性能检测等报告。
- 其他相关文件:如授权委托书等。
五、总结
备案一类医疗器械产品是确保产品合法上市的关键步骤。了解备案流程、注意事项及所需文件清单,将有助于企业顺利完成备案工作,保障产品的安全性和有效性。希望本文能为相关企业和个人提供有价值的参考信息。






























